治験・臨床研究に関わっている人たち
AIで生成した概要を聞くことができます。 |
医師主導治験とは
治験には「医師主導治験」と「企業主導治験」があります。
医師主導治験は治験の準備から管理を医師自ら行い、企業主導治験は企業が主体となって行うという違いがあります。
治験は患者さんの安全性と試験の信頼性を確保するために、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)」という法律と薬機法に基づいて制定された「医薬品の臨床試験の実施の基準に関する省令(GCP)」という規則を守って行わなければなりません。
医師主導治験の流れ
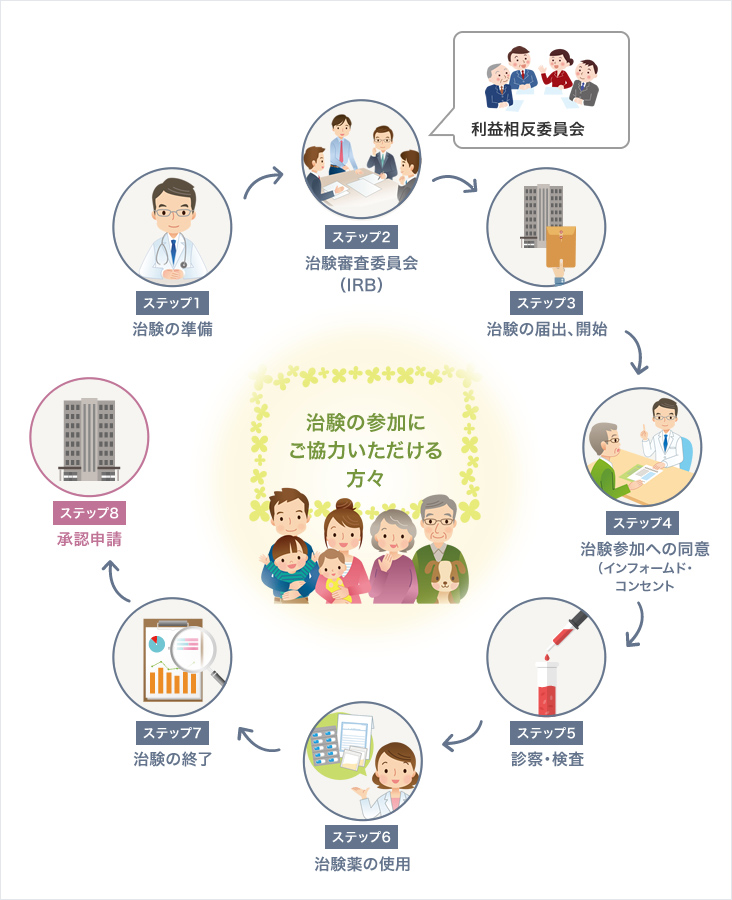
- ステップ1
治験の準備 - 医師が治験を計画し準備を行います。
- ステップ2
治験審査委員会(IRB) - 治験の倫理性・科学性を審査します。
実施中も計画通りに問題なく実施されているかを定期的に確認します。 - ステップ3
治験の届出、開始 - IRBで承認後、厚生労働省へ治験の届出をします。
届出受理後、治験が開始されます。 - ステップ4
治験参加への同意
(インフォームド・コンセント) - 医師や治験コーディネーター(CRC)から治験についてご説明します。
患者さんご自身の自由意思で治験への参加を決めていただきます。 - ステップ5
診察・検査 - 治験中は、血液検査等を定期的に行い、安全性を確保しながら治験を行います。
- ステップ6
治験薬の使用 - 治験薬を安全に使用していただくために、薬剤師が服薬指導を行います。
- ステップ7
治験の終了 - 治験終了後、集めたデータを分析・解析します。
- ステップ8
承認申請 - 治験結果を厚生労働省へ承認申請します。
臨床研究(治験以外)
治験以外の臨床研究においても以下のような規則を守って試験を実施する必要があります。
- 臨床研究法
- 人を対象とする生命科学・医学系研究に関する倫理指針
- 再生医療等の安全性の確保等に関する法律
臨床研究(治験以外)の流れ
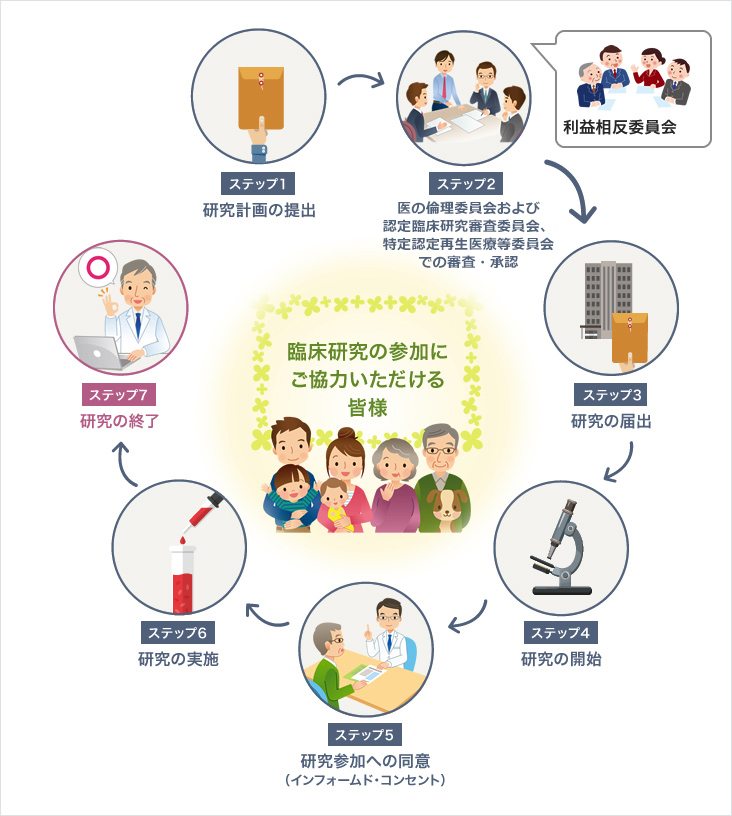
- ステップ1
研究計画の提出 - 責任医師から病院長へ研究計画を提出します。
- ステップ2
医の倫理委員会および認定臨床研究審査委員会、特定認定再生医療等委員会での審査・承認 - 研究の倫理性・科学性を審査します。
実施中も計画通りに問題なく実施されているかを定期的に確認します。 - ステップ3
研究の届出 - 再生医療に関する研究と一部の臨床研究については厚生労働省へ届出をする必要があります。
- ステップ4
研究の開始 - 医の倫理委員会および特定認定再生医療等委員会で承認後、病院で研究が開始されます。
- ステップ5
治験参加への同意
(インフォームド・コンセント) - 医師や臨床研究コーディネーター(CRC)から研究についてご説明します。
患者さんご自身の自由意思で研究への参加を決めていただきます。 - ステップ6
研究の実施 - 研究計画に沿って採血等検査を行います。
- ステップ7
研究の終了 - 研究で得られた結果は将来の医療の貢献につながります。
- 臨床研究(治験)担当医師
患者さんの主治医の立場で臨床研究(治験)を行う人です。臨床研究(治験)責任医師と臨床研究(治験)分担医師がいます。 - 臨床研究(治験)責任医師
病院の中で臨床研究(治験)業務を統括し、責任を持つ医師です。
臨床研究(治験)を適正に行うための教育と訓練を受け、十分な臨床経験を持つことが求められます。 - 臨床研究(治験)分担医師
臨床研究(治験)責任医師の指導の下に、治験に係る業務を担当する医師です。 - 臨床研究(治験)コーディネーター
臨床研究(治験)責任医師の指導の下に、臨床研究(治験)の支援業務を行うスタッフです。患者さんのケア、臨床研究(治験)担当医師のサポート、治験依頼者の対応等を行い、全体をコーディネートすることによって、臨床研究(治験)が適切にスムーズに進むように仕事をしています。薬剤師、看護師、臨床検査技師の資格を持った人が多いです。 - 治験審査委員会
治験の計画が患者さんの人権に十分配慮されているか、倫理的かつ科学的に問題がないか等を審査する役割を担っています。 医療関係者、病院と利害関係のない人、医学・薬学の専門家以外の人たちで構成されています。 - 医の倫理委員会
治験以外の臨床研究について、研究計画が患者さんの人権に十分配慮されているか、倫理的かつ科学的に問題がないか等を審査する役割を担っています。 医療関係者、弁護士など倫理学・法律学などの専門家、病院と利害関係のない人、医学・薬学の専門家以外の人たちで構成されています。 - 認定臨床研究審査委員会
臨床研究法という法律に基づき実施する臨床研究について、研究計画が患者さんの人権に十分配慮されているか、倫理的かつ科学的に問題がないか等を審査する役割を担っています。 医療関係者、弁護士など倫理学・法律学などの専門家、医学・薬学などの専門家以外の人たちで構成され、厚生労働省から認定を受けています。 - 特定認定再生医療等委員会
再生医療が患者さんの人権に十分配慮されているか、倫理的かつ科学的に問題がないか等を審査する役割を担っています。 再生医療等の専門家、法律や生命倫理の専門家、医学・薬学などの専門家以外の人たちで構成されています。 - 利益相反委員会
臨床研究(治験)の倫理性及び科学性に影響がないよう、責任医師/分担医師など臨床研究(治験)を実施する組織と製薬企業などとの間の利害関係を適切に審査・管理します。